科研进展
重要突破 | 金凤实验室团队发现恶性胶质瘤内肿瘤相关巨噬细胞新亚群及其在肿瘤血管正常化中的治疗意义
肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)在恶性实体肿瘤内高度浸润,促进肿瘤演进和免疫抑制微环境形成。当下,靶向TAM的免疫治疗策略研发如火如荼的开展,包括阻断TAM募集、增强TAM吞噬、调控TAM极化和代谢重编程、嵌合抗原受体巨噬细胞(Chimeric antigen receptor-macrophage)疗法在内的临床试验逐年增加,但其治疗效果和转化价值仍相对有限。究其原因,与TAM来源、瘤内分布和表型的高度异质性有关。深入阐释TAM异质性和形成机制是研发靶向TAM肿瘤免疫治疗新策略的关键。
恶性胶质瘤是中枢神经系统原发恶性肿瘤,抵抗常规治疗,复发率高,患者生存期短。恶性胶质瘤内TAM由外周单核细胞和脑组织驻留小胶质细胞极化而形成。与在瘤旁富集的小胶质细胞来源的TAM(microglia-derived TAMs,Mg-TAM)不同,单核细胞来源的TAM(monocyte-derived TAMs,Mo-TAM)多在胶质瘤瘤体内富集,且其含量增加与肿瘤复发和患者预后不良有关。然而,胶质瘤内不同空间区域的Mo-TAM是否存在表型异质性及其形成机制尚不清楚。
重磅发现
Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization
2024年4月18日,陆军军医大学第一附属医院(重庆西南医院)全军临床病理学研究所卞修武院士、时雨副教授、平轶芳教授(金凤实验室重庆先进病理研究院兼职PI)团队联合陆军军医大学第一附属医院脑胶质瘤医学研究中心、神经外科李飞副教授、华中科技大学武汉光电国家研究中心张智红教授团队的祁淑红副研究员在Cancer Cell上发表了题为Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization的研究论文,系统揭示了恶性胶质瘤内Mo-TAM的转录表型和空间分布异质性特征,鉴定出缺氧坏死微环境内富集的TAM缺氧亚群(Hypoxia-TAM)并证实其诱导微血管渗漏表型,阐明了靶向该亚群对胶质瘤血管正常化和提高抗肿瘤药物递送效率的治疗学意义。

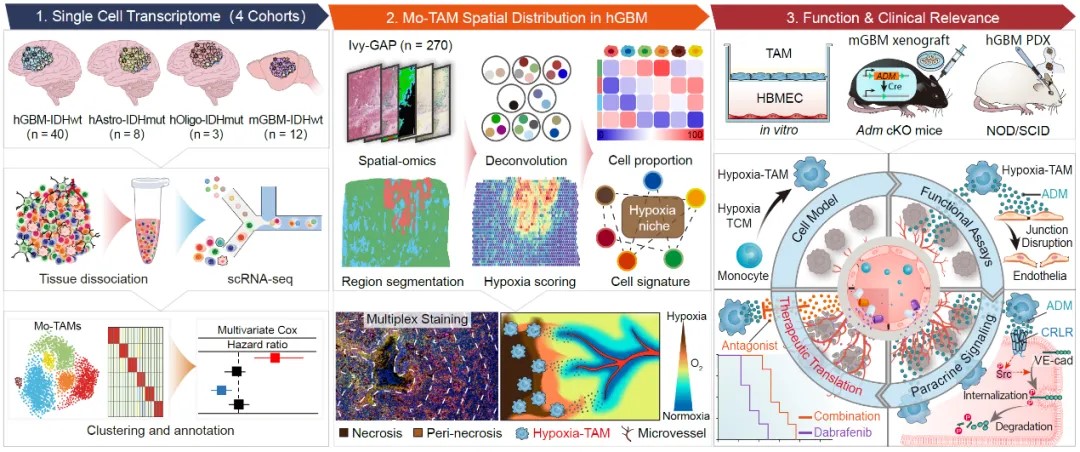
该研究包括以下主要发现:
1. 利用单细胞多组学技术绘制了恶性胶质瘤Mo-TAM空间图谱,发现缺氧坏死区高度富集Hypoxia-TAM亚群
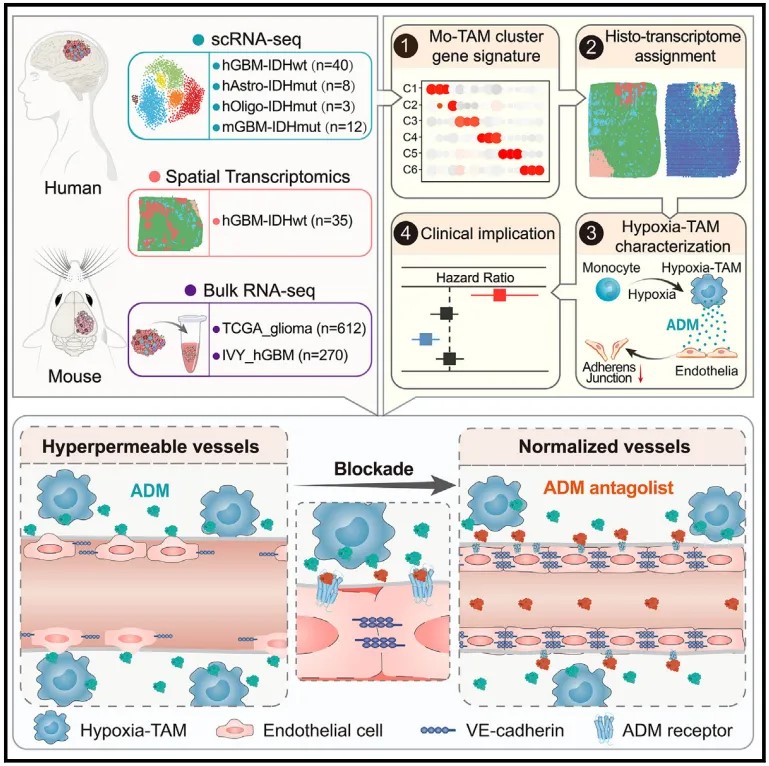
该团队分析了51例人恶性胶质瘤内的36万个单细胞转录组数据,绘制了Mo-TAM的单细胞图谱;鉴定出具有缺氧响应、趋化运动、吞噬和抗原呈递、脂代谢依赖、干扰素产生、核糖体合成特征的Mo-TAM新功能亚群,并证实Mo-TAM多个亚群的转录特征在小鼠胶质瘤和多种人实体肿瘤中具有高度保守性;阐明了Mo-TAM亚群构成与胶质瘤类型、肿瘤级别、肿瘤分子变异和患者预后的相关性。他们还分析了35例人恶性胶质瘤空间转录组数据,建立了Mo-TAM不同亚群转录组特征与胶质瘤组织病理结构(血管富集区、缺氧坏死区和侵袭前沿区)的空间映射网络,绘制了Mo-TAM空间分布图谱,明确了不同Mo-TAM亚群在血管富集区、缺氧坏死区和侵袭前沿区的分布差异。他们利用多色免疫荧光成像,证实了Hypoxia-TAM亚群在胶质瘤缺氧坏死区高度富集,并解析了空间缺氧梯度与Hypoxia-TAM表型转化、胶质瘤细胞间质型转化、糖酵解代谢重编程和微血管增生的相关性。
2. 阐明了缺氧坏死微环境诱导Hypoxia-TAM亚群表型极化的关键机制
该团队利用体外人外周血单核细胞和小鼠骨髓来源巨噬细胞模型,分析了恶性胶质瘤缺氧坏死区内肿瘤因素和缺氧因素对诱导单核细胞向Hypoxia-TAM表型极化的影响。通过bulk转录组、蛋白质组和糖酵解代谢产物的整合多组学分析,系统筛选并鉴定出缺氧坏死微环境内胶质瘤细胞产生的富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine,SPARC)和低氧诱导产生的乳酸是Hypoxia-TAM亚群极化的关键机制,证实两种因素协同诱导Mo-TAM内p50入核并增强Hypoxia-TAM核心表型基因转录。
3. 发现Hypoxia-TAM是诱导恶性胶质瘤微血管高度渗漏的重要原因,建立了靶向Hypoxia-TAM以诱导胶质瘤血管正常化,提高抗肿瘤治疗药物递送和疗效的治疗新策略
高度增生、高渗漏和低灌注的胶质瘤微血管是限制抗肿瘤药物递送和导致肿瘤细胞耐药的重要因素。鉴于恶性胶质瘤缺氧坏死灶周围大量富集新生的微血管,该团队进一步分析了Hypoxia-TAM对血管生成和微血管结构完整性的影响,发现Hypoxia-TAM能大量合成并分泌肾上腺髓质素(adrenomedullin,ADM),导致胶质瘤内微血管内皮细胞间的黏附连接破坏,进而引发血管高渗漏和血流低灌注。敲除Ccr2-Cre转基因小鼠中单核细胞及其衍生细胞内Adm,或采用ADM拮抗剂阻断ADM旁分泌通路,能抑制小鼠胶质瘤内血管生成,恢复内皮连接完整性并减少血管渗漏,从而诱导肿瘤内微血管结构正常化。他们在BRAF-V600E突变的人胶质母细胞瘤移植瘤中证实ADM拮抗剂与BRAF小分子抑制剂达拉非尼(Dabrafenib)联用,能增加达拉非尼的瘤内灌注,更有效地抑制肿瘤生长,延长荷瘤小鼠生存期。
综上所述
该研究利用单细胞多组学技术绘制恶性胶质瘤TAM空间图谱,鉴定出缺氧微环境内Hypoxia-TAM新功能亚群并阐明其形成机制,提出并建立了靶向拮抗Hypoxia-TAM旁分泌ADM以诱导胶质瘤血管正常化,提高抗肿瘤治疗药物灌注和疗效的治疗新策略。上述内容加深了我们对胶质瘤免疫微环境空间异质性特征和形成机理的认识,有望用于推动靶向胶质瘤内不同来源、不同功能TAM的免疫治疗新策略和抗肿瘤血管生成新策略的研发。
陆军军医大学西南医院病理科(病理学研究所)硕士生王文英、博士生李天然和程玥,神经外科李飞副教授,华中科技大学武汉光电国家研究中心祁淑红副研究员为该论文的并列第一作者。陆军军医大学附属西南医院病理科(病理学研究所)卞修武院士、时雨副教授和平轶芳教授(金凤实验室重庆先进病理研究院兼职PI)为共同通讯作者。陆军军医大学第一附属医院神经外科冯华教授、胡荣教授,全军临床病理研究所刘新东教授(金凤实验室兼职PI)、王岩教授(金凤实验室兼职PI)、刘浩飞博士(金凤实验室研究员),华中科技大学武汉光电国家研究中心张智红教授,陆军军医大学第二附属医院朱波教授(金凤实验室兼职PI)等也为这项研究提供了建议或技术指导。
|
 2024年4月19日
2024年4月19日

